* 먼저 혼동하지마시라고 적습니다. 지금 제가 기술할 슈뢰딩거의 파동함수(파동방정식)은 현대물리학 수준에서 다루는 급으로 쓰진 않습니다. 일반화학에 실려있긴한데 그저 전자가 존재할 확률밀도함수에 대한 이야기만 적을생각입니다.
그냥 넘어가려했으나 2019학년도 편입화학 시험에서 프사이 제곱의 의미를 묻는 문제가 출제되었다고 합니다. 따라서 짚고넘어가는게 좋을것 같아 기술합니다.
간단히 보고 끝내겠습니다. 파동함수 그래프를 봅시다.
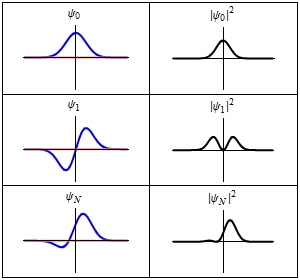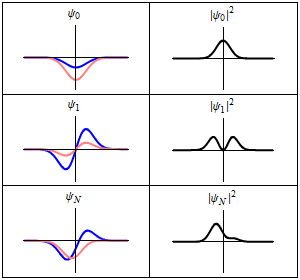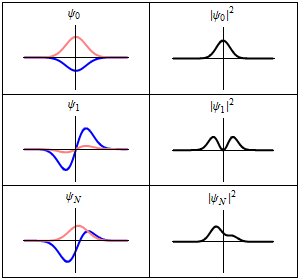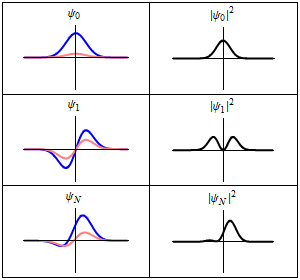
위 그래프를 보면 프사이인 경우에는 음의 값을 가집니다. 그런데 우리는 이전시간에도 배웠지만 입자가 발견될 확률에 대해 논하고자 합니다. 따라서, 확률의 범위는 [0,1]이기 때문에 제곱을 취해주게 됩니다. 프사이 제곱. 바로 이것의 의미에 대해 묻는 문제가 작년에 나왔다고 하니 잘보도록 합시다.
근데 프사이 제곱을 위에서 아래로 1,2,3번이라 한다면 2번 에서 원점에서 0값을 가지는 것을 알 수 있습니다.
이 지점을 우리는 'Node' 라고 부릅니다. 수소원자모델과 비교하자면 광자의 에너지가 흡수 또는 방출될 때, 정수배로 변한다고 언급했었죠? 즉, n=1 궤도, n=2 궤도 이러한 곳에서나 전자가 발견되지, 이 두 궤도 사이의 간격에서는 전자가 관찰되지 않는다는 말입니다. 즉, Node는 전자가 발견되지 않을 확률이 0인 지점을 의미한다고 받아들이시면 됩니다.
전 포스팅에서 제가 언급해드렸지만 n은 주양자수를 의미한다고 했었습니다. 이제 이것과 비슷한 것들을 알아보도록 합시다.
★양자수
- 양자수에는 주양자수, 부양자수(각운동량양자수), 자기양자수, 자기스핀양자수 이렇게 존재합니다.
1) 주양자수 = 에너지의 크기를 의미합니다. 이외의 양자수는 에너지의 크기를 의미하지 않습니다. 원소 주기율표로 따지면 주양자수 n이 1인 것은 1주기를 의미하며, n=3은 3주기를 의미합니다.
n=1,2,3,4,...... 이런식으로 늘어나며 n=0이란 것은 없습니다.
2) 부양자수 = 오비탈 모양을 의미합니다. l (소문자 엘입니다.) 로 표현하며 주양자수와는 l=1,2,...., (n-1)이라는 관계를 가집니다. 무슨말이냐면 예를 들어 n=2면 l은 0,1을 가진다는 말입니다.
l=0은 s오비탈을, l=1은 p오비탈을, l=2는 d오비탈을 l=3은 f오비탈을 의미합니다.
* 오비탈이란?

구형이 s오비탈, 아령모형이 p오비탈이고 아령 두개와 도넛 하나가 d오비탈입니다. 우리는 일반화학 범위내에서는 d오비탈까지만 봐도 됩니다.
3) 자기 양자수 = 자기 양자수는 각각의 오비탈 방향을 의미합니다. 이녀석과 부양자수와의 관계는 절댓값을 의미합니다. 무슨 말이냐면 만약 n=3이라 합시다. 그러면 l은 0,1,2가 됩니다. 그렇죠? 여기서 자기 양자수는
-2,-1,0,1,2가 됩니다. 총 5개죠. 자, 보세요. 제가 예시로 준 양자수들을 보면 3주기에 해당하며 최대 d오비탈까지 가질 수 있음을 보여주고 있습니다. 그리고 여기서 자기 양자수를 구함으로써 d오비탈이 총 5개 존재할 수 있다는 것을 알게되었죠. 위 그림을 보시면 이제 이해가 되실겁니다. d오비탈의 방향이 5개있음을 알 수 있죠?
4) 자기 스핀 양자수 = 자기 스핀 양자수는 -1/2,+1/2로 나타냅니다. -1/2, +1/2는 하나의 오비탈에 2개의, 스핀 방향이 다른 전자가 들어있음을 의미합니다.
'대학화학 > 일반화학1' 카테고리의 다른 글
| [원소 주기적 성질] 유효 핵전하 & 원자 반지름 & 이온 반지름 & 등전자계열 (0) | 2019.11.05 |
|---|---|
| [양자화학] 전자배치의 기초 <축조원리 & 파울리 배타 원리 & 훈트 규칙> (0) | 2019.11.01 |
| [양자화학] 보어의 수소 원자 모델 이론 (Bohr's theorem) & 불확정성 원리 (Uncertainty principle) (0) | 2019.10.31 |
| [열화학] 비열과 열용량에 대한 열계량법과 결합 엔탈피 (0) | 2019.10.31 |
| [열화학] 표준생성 엔탈피와 헤스의 법칙 (Hess's law) (0) | 2019.10.30 |


