
강산과 강염기의 당량점은 pH7.0입니다. 우리가 pH 7.0이라 하면 딱 중성인 부근을 말하죠? 산-염기 적정표에서 산성도와 염기성도의 상대적 위치가 비슷한 애들은 보통 pH농도가 7.0이곤 합니다. (강산&강염기만)
여기서 말하는 당량점과 우리가 아는 종말점이 무엇인지 설명하겠습니다.
1) 당량점이란? 산과 염기가 만나서 중화 반응을 일으킬 때, 산과 염기의 몰 수가 똑같은 양으로 반응하는 지점을 말합니다. 예를 들어, 강산 HCl이 0.1M의 농도로 100ml의 부피로 담겨있는 비커에다가 강염기NaOH (0.1M의 농도)를 첨가했다고 합시다. 이 둘이 당량점이 도달하려면 둘은 똑같은 몰 수가 되야합니다.
강산 HCl의 몰수는 0.01mol이니까, 마찬가지로 강염기가 0.01mol이 되려면 100ml의 NaOH를 첨가해줘야합니다.
그래야 당량점에 도달합니다.
2) 종말점이란? 우리가 지시약을 사용해서 수용액의 pH농도변화를 확인하곤 합니다. 대표적인게 우리가 중학생때배우는 양배추 지시약 혹은 리트머스 종이, 페놀프탈레인, 메틸 오렌지 등등이 있죠? 이들은 어느시점부터 수용액의 색깔이 변하게 되는 지점을 육안으로 확인할 수 있게 해줍니다. 우리는 색이 완전히 변하는 그 지점을 '종말점'이라 합니다.
근데 종말점과 당량점은 확실히 차이가 있습니다. 왜냐하면 당량점은 pH미터기를 통해 기록하는 것이기 때문에 훨씬 정확합니다. 위에 강산&강염기 적정곡선을 보시면 알겠지만 NaOH의 부피가 25ml근방에서 pH농도가 급격하게 변하는 것을 알 수 있습니다. 즉, 우리가 눈으로 봤을 때 '아! 중화반응 일어났구나!' 하는 부분은 이미 실제 당량점인 pH7을 훨씬 넘어선 pH11근처다. 이말입니다. 이해가시나요? ㅎㅎ
즉, 종말점은 육안으로 봤을 때 중화반응이 끝난 지점을 의미합니다. 당량점은 pH미터기를 사용했을 때 적정이 완료된 지점을 보여주는 부분입니다.
그러면 pH를 계산해봄으로써 강산&강염기 적정곡선이 과연 저러한 형태로 급격히 변하는지 문제 하나를 통해 확인해보도록 하겠습니다.

보시면 눈치채셨다시피, 몰농도가 같습니다. 그러면 몰수가 같으려면 부피도 같아야 합니다. 그래야 당량점에 도달할테니까요. 근데 단, 0.1ml의 차이로 pH농도가 얼마나 달라지는지 보도록 하겠습니다.
위 문제는 대표적인 강염기와 강산의 적정 문제입니다.
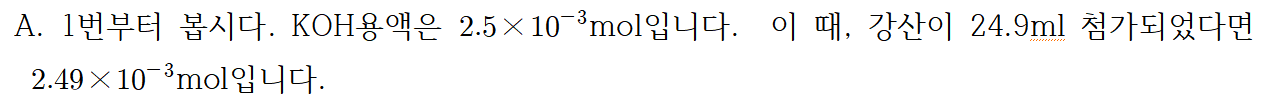
| 여백의 미 | OH- | H+ | H2O |
| 초기 | 2.5*10^-3mol | 2.49*10^-3mol | 0 |
| 반응 중 | -2.49*10^-3mol | -2.49*10^-3mol | +2.49*10^-3mol |
| 평형 | 0.01*10^-3mol | 0 | +2.49*10^-3mol |
이 때 물은 농도에 영향을 주지 않으므로, 고려하지 않습니다. 그러면 OH의 농도를 구할 수 있습니다. 총 부피는 49.9ml가 되었으니까, pOH는 대략 3.7입니다. 그러나 우리가 알고자 하는 것은 pH농도이므로 14에다 3.7을 빼면 10.3이 됩니다. 그게 1번의 답입니다. 2번도 마찬가지로 해주시면 됩니다. 그러면 pH농도는 3.7이 됩니다.
어떤가요? 단, 0.2ml의 차이인데 10.3에서 갑자기 3.7까지 떡락했습니다. 이게 바로 강염기에다가 강산을 적정시켰을 때의 결과입니다. 만약 강산에다 강염기를 적정시키면 반대로 당량점 부근에서 떡상하겠죠?
'대학화학 > 일반화학2' 카테고리의 다른 글
| [수용액 평형] 용해도 평형과 이온 침전 (0) | 2019.10.27 |
|---|---|
| [수용액 평형] 약산과 약염기 적정 & 지시약 채택 (0) | 2019.10.27 |
| [수용액 평형] 헨더슨 하셀바흐식(Henderson-Hasselbalch equation) (0) | 2019.10.23 |
| [수용액 평형] 공통 이온 효과(Common ion) & 완충 용액 (Buffer solution) (0) | 2019.10.23 |
| [산&염기 평형] 다양성자산 (Polyprotic acid) & 염 용액의 산염기 성질 (0) | 2019.10.23 |


