헨더슨 하셀바흐식을 공부하기 전에 먼저 하나 알아야할 개념이 있습니다. 바로 pKa, pKb입니다. 이 두개는 산해리상수와 염기해리상수를 -log로 취해줌으로써 우리가 pH농도나 pOH농도를 구할 때처럼 똑같이 접근하면 됩니다.
만약 완충용액이라면 pKa=pH인 상태겠죠? 자, 그러면 이제 헨더슨 하셀바흐식을 봅시다.


| 여백의 미 | 락트산 | H+ | 락트산 이온 |
| 초기 | 0.12M | 0 | 0.10M |
| 반응 중 | -x | +x | +x |
| 평형 | (0.12-x) | x | (0.10+x) |
왜 이렇게 되는지 아시죠? 락트산과 락트산 소듐을 섞고자합니다. 이 때, 소듐은 산염기적 거동을 전혀 하지 않는 친구이므로 고려할 필요가 없습니다. 위 식을 이제 근사식을 사용해도 된다고 가정하고 x를 구하도록 합시다. 해리상수까지도 주어졌으므로 우리는 겁먹을 필요가 없습니다.
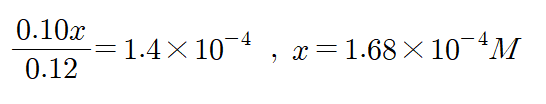
이렇게 나오네요. 그러면 근사식을 사용해도 좋았는지 검토해봅시다. 초기 농도 0.12M에서 0.05만큼 곱했더니 6*10^-3로 근사식을 사용해도 좋았군요. 자, 그러면 이제 헨더슨 하셀바흐 식에 적용합시다.
락트산 이온 0.1M에 저 x값을 대입해봤자 별 차이가 없다는 것을 보였기 때문에 그냥 log(0.1/0.12)를 넣고 pKa와 더해주면 이제 문제는 풀립니다. pKa는 -log[Ka]를 이용하면 됩니다.
답이 pH 3.77으로 나온다면 여러분은 맞게 푸신겁니다.
몇개 더 풀어봅시다.

어려운거 아닙니다. 단지 응용이죠. 풀이 한번 볼게요.
일단 암모니아는 대표적인 약염기이므로 pH를 pOH농도로 바꿔줍시다. 그러면 4.8이죠?

혹시나 지금 제 설명이 이해가 안간다면 네이버 블로그에 헨더슨 하셀바흐 식에 관한 포스팅을 읽어보시길 바랍니다.
반복해서 말씀드려 죄송하지만 티스토리 블로그에 쓰는 것들은 화학을 1회독 하고 오신분들에게 눈맞춤하는 내용입니다.
https://blog.naver.com/twonkang00/221543417379
[수용액평형] 완충용액과 헨더슨하셀바흐 식
완충용액의 정의 : 약산과 짝염기가 수용액에서 비슷한 비율로 녹아있는 것. ( *반드시 약산이여야만 함)완...
blog.naver.com
'대학화학 > 일반화학2' 카테고리의 다른 글
| [수용액 평형] 약산과 약염기 적정 & 지시약 채택 (0) | 2019.10.27 |
|---|---|
| [수용액 평형] 당량점과 종말점의 차이와 강산&강염기 적정 (0) | 2019.10.27 |
| [수용액 평형] 공통 이온 효과(Common ion) & 완충 용액 (Buffer solution) (0) | 2019.10.23 |
| [산&염기 평형] 다양성자산 (Polyprotic acid) & 염 용액의 산염기 성질 (0) | 2019.10.23 |
| [산&염기 평형] 약산과 약염기 해리 & 이온화 백분율 공식 (Percent ionization) (0) | 2019.10.22 |



