전기화학의 메인 공식입니다. 먼저 깁스프리 에너지와 기전력과의 상관관계를 알아보도록 합시다.
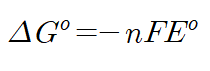
위 공식을 봅시다. 왼쪽은 오랜만에 등장하는 표준 상태에서의 깁스 프리에너지입니다. 오른쪽 변에 있는 것은
n과 F, 그리고 표준 환원 전위네요! n은 우리가 바로 이전 글에서 표준환원 전위표를 볼 때, 전자의 이동을 포함한 많은 화학 반응식들을 봤을 겁니다. n은 바로 전자의 이동개수를 의미합니다. 이전에 예로 들었던 구리-아연 전지를 보시면
전자는 2개 이동합니다. 즉, 여기서 n은 2가 됩니다.
다음은 F를 봅시다. F는 패러데이 상수를 의미합니다. 값은 96485C/mol 를 의미합니다. 외워두시는게 좋습니다.
다만 편입시험에서는 계산기가 허용 불가하므로 계산하기 편한 96500으로 주어지던가 할겁니다.
아무튼 여러분들이 저 식에서 주목해야하실 것은 음수입니다. 깁스프리에너지가 자발성을 띠려면 어떠한 형태여야 한다고 했죠? 네. 그렇습니다. 음수여야 하죠. 까먹지 마시길 바랍니다. 우리는 구리-아연 전지에서 표준환원전위 값을 구했을 때 그 값이 양수로 나왔었습니다. 그렇다면 여기서 알 수 있는 사실은! 깁스프리에너지는 음수일 때 그리고 표준환원전위 값은 양수일 때 '자발적이다' 라고 결론 지을 수 있겠습니다!
우리는 지금까지 표준상태에서의 에너지와 기전력을 봐왔습니다. 그러면 이제는 비표준 상태일 때를 보고자 합니다.
비표준 상태일 때 기전력을 구하는 공식이 바로 '네른스트 식' 입니다. 공식은 다음과 같습니다.

왼쪽과 오른쪽의 차이는 자연로그냐 아니면 상용로그냐의 차이입니다. 의외로 이거 두개 차이 인지못하고 푸셔서 값이 다르게 나온다고 하시는 분들 많습니다. 꼭 유념해두세요. 만약 왼쪽 식에서 오른쪽 식으로 바꾸고자 한다면 왼쪽에 RT/nF에다가 2.302을 곱해주면 됩니다. 한편, 오른쪽 식은 변수대신 제가 바로 계산하여 0.0592라는 값을 주었는데요.
이 경우는 온도가 25도인 상태를 의미합니다. 만약 온도가 25도가 아니라면 여러분들은 일일이 다시 곱해줘서 구해야하겠죠? 그래서 왠만하면 25도라고 주어질겁니다.
네른스트 식은 꼭 서로 다른 두 전지에 대한 기전력 공식으로 쓰는 건 아닙니다. 같은 전지라고 해도 용액의 농도차가 존재한다면 미세하게 나마 기전력 값이 검출되곤 합니다. 이 때의 전지를 '농도 전지' 라고 부릅니다.
'대학화학 > 일반화학2' 카테고리의 다른 글
| [전기화학] 볼타 전지 or 갈바니 전지 (Galvanic cell , Voltaic cell) & 표준환원전위 표 (0) | 2019.12.05 |
|---|---|
| [전기화학] 반쪽 반응법 (Half Reaction) (0) | 2019.11.08 |
| [화학열역학] 비표준 상태에서의 자유 에너지 & 반응지수와의 관계 (0) | 2019.11.07 |
| [화학열역학] Gibbs Free Energy (깁스 프리 에너지) (0) | 2019.11.06 |
| [화학열역학] 자발적 과정 & 엔트로피와 열역학 제 2법칙 (0) | 2019.11.06 |



