전기화학의 시작입니다. 교재에 따라 볼타 전지 혹은 갈바니 전지라고 불립니다. 저는 볼타 전지라고 부르겠습니다. 글자수가 더 짧으니까요 ㅎㅎ
이는 상대적인 산화&환원 세기를 이용하여 기전력을 얻고자 하는 방식에서 구현된 전지입니다. 기전력이 뭔가요?
연세대 편준생이라면 당연히! 물리도 하셨겠죠? 전위차라고 봐야겠죠? 전위차의 정의가 정확히 뭐죠?
전기적 포텐셜 에너지의 차이를 의미합니다. 즉, 위치에너지를 이용하여 전압을 얻어낸 것입니다.

가장 대표적인 구리-아연 볼타 전지입니다. 설명 해드리겠습니다. 아연전극을 보세요. 전자가 구리전극쪽으로 이동하는게 보이시죠? 즉, 아연은 현재 산화되고 있다는 의미입니다. 그렇기 때문에 Zn은 (Zn^2+ + 2e^-)로 변하게 되죠.
그러면 구리는 환원되는 애겠죠?
자, 여기서 이제 용어 하나 들어갑니다. 미지의 두 전극이 주어졌을 때, 상대적인 환원세기에 의해 전자를 잃는 전극을
'산화 전극' 이라고 부릅니다. 그리고 전자를 얻는 전극을 '환원 전극' 이라고 부릅니다. 산화되는 전극은 초기의 상태보다 질량손실이 발생하게 되고 용액의 색은 옅어지게 됩니다. 그리고 환원되는 전극은 초기의 상태보다 질량이 조금 늘어나게 되고 용액의 색은 짙어지게 됩니다. 그렇게 평형을 이루게 되면 두 용액의 색은 비슷해집니다.
그렇다면 전극의 환원세기를 비교할 수 있는 표가 당연히 존재할 것입니다. 우리는 그 표를 '표준환원전위표' 라고 부릅니다.

여러 화학반응식이 보이고 왼쪽에 일련의 숫자들이 보입니다. 제일 위쪽에 있는 애가 가장 강한 환원세기를 가지는 녀석입니다. 즉, 가장 강한 산화제입니다. 그리고 제일 아래에 있는 애가 가장 강한 산화세기를 가지는 녀석입니다. 따라서, 가장 강한 환원제가 되겠습니다. 우리가 위에서 봤던 구리-아연 전지를 비교해봅시다.
구리의 경우는 0.34V의 기전력을 가집니다. 그리고 아연의 경우는 -0.76V의 기전력을 가집니다. 따라서 이 둘의 크기를 비교하면 구리가 환원되는 녀석이고 아연이 산화되는 녀석입니다. 즉, 제가 말씀드렸던 것이 맞는 방향의 반응임을 증명하게 됩니다.
그러면 표준 환원 전위를 구하는 공식을 한번 봅시다.
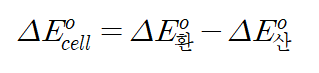
환원전극의 기전력 - 산화전극의 기전력의 값이 표준 환원 기전력값이 됩니다. (전위 = 기전력)
'대학화학 > 일반화학2' 카테고리의 다른 글
| [전기화학] 네른스트 식 (Nernst Equation) & 깁스 프리에너지와의 상관관계 (0) | 2019.12.05 |
|---|---|
| [전기화학] 반쪽 반응법 (Half Reaction) (0) | 2019.11.08 |
| [화학열역학] 비표준 상태에서의 자유 에너지 & 반응지수와의 관계 (0) | 2019.11.07 |
| [화학열역학] Gibbs Free Energy (깁스 프리 에너지) (0) | 2019.11.06 |
| [화학열역학] 자발적 과정 & 엔트로피와 열역학 제 2법칙 (0) | 2019.11.06 |



