화학반응속도에 영향을 주는 인자로 우리는 농도를 예로 들었었습니다. 농도가 짙을수록 반응속도는 빨라진다는 것이였죠. 그리고 앞에서 반응차수에 따른 반감기 식을 유도해냈었습니다. 일반화학 수준에서는 0차,1차,2차만 알아도 무난하므로 잘 복습해두시길 바랍니다.
오늘 할 것은 아레니우스 식으로 활성화에너지와 온도가 반응속도상수에 어떠한 영향을 미치는지 보도록 할 것입니다.
반응속도상수가 크다는 것은 반응속도도 빠르다는 이야기이니까요. 먼저 식부터 봅시다.
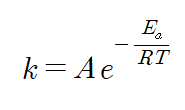
k는 반응속도상수입니다. A는 충돌인자입니다. 그냥 충돌 수라고 알아두시면 됩니다. Ea는 활성화에너지를 뜻하구요. R은 기체상수입니다. 주의해야할 것은 활성화'에너지'이기 때문에 R 역시 '줄'단위로 바꿔줘야 합니다. 따라서 여기서 기체상수의 값은 8.314J입니다. 그리고 T는 절대온도를 의미합니다. 아레니우스 식 역시 선형방정식으로 유도가 가능합니다. 한번 봅시다.

그러면 활성화에너지가 낮을수록 반응속도가 빨라진다는 것을 알 수 있겠습니다. 또한 온도가 높을수록 반응속도가 빨라진다는 것도 이제 유추가 가능하죠? 활성화에너지에 대한 그래프를 같이 봐봅시다.
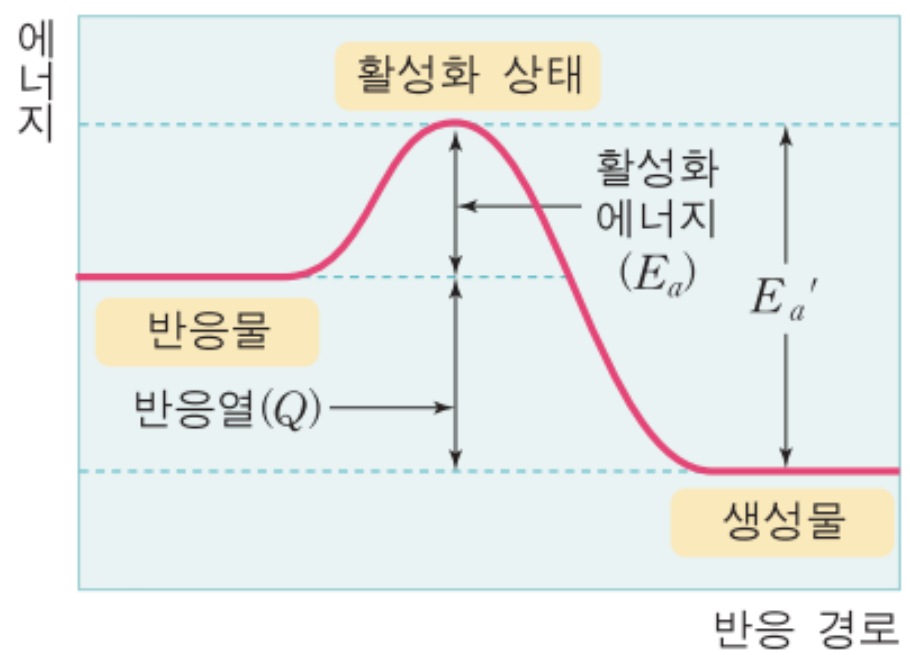
반응물에서 생성물로 진행되는 과정에서 문턱이 하나 있습니다. 그 문턱만큼의 크기를 활성화에너지라고 합니다.
활성화에너지라는 것은 반응이 일어나는데 요구되는 최소한의 에너지를 의미합니다. 반응물이 서로 만난다고 해서 사실 바로 반응이 일어나는 것은 아닙니다. 그러면 역반응을 봅시다. 생성물에서 반응물로 돌아가기 위해서 요구되는 문턱의 크기는 확실히 정반응에서의 활성화 에너지보다 크죠? 역반응 활성화에너지와 정반응 활성화에너지를 뺀값을 우리는
'엔탈피 변화량' 이라고 부릅니다. 다만 주의하셔야할 것은 엔탈피변화량은 반응속도에 어떠한 영향을 끼치지 않습니다.
그러면 위 그래프는 흡열반응일까요, 발열반응일까요?
네. 그렇습니다. 답은 발열반응이죠? 반응물 -> 생성물로 되는 과정에서 엔탈피가 양수이므로 발열반응입니다.
'대학화학 > 일반화학2' 카테고리의 다른 글
| [화학평형] 평형상수 공식 (Equilibrium Constant Equation) (0) | 2019.10.22 |
|---|---|
| [화학반응속도론] 반응 메커니즘 (Reaction mechanism)과 속도 결정 단계 (Rate Determining step) (0) | 2019.10.22 |
| [화학반응속도론] N차반응에 대한 반감기 (1차반응,2차반응,0차반응) (3) | 2019.10.21 |
| [화학반응속도론] 농도와 속도법칙 (0) | 2019.10.21 |
| [화학반응속도론] 화학 반응 속도론 기초 (0) | 2019.09.13 |



